一、
實驗目的
1、掌握用電解氧化法將葡萄糖氧化成葡萄糖酸;
2、探討不同因素對葡萄糖酸產率的影響;
3、培養團隊協作精神;
4、完成一次完整的研究實驗訓練,掌握基本的實驗研究能力。
二、
實驗原理
葡萄糖酸及其系列衍生物是一類多用途的重要有機產品,在食品工業中被廣泛用作酸味劑、發酵劑、防腐劑、營養增補劑、色調保持劑、蛋白質凝固劑等。本實驗采用電解氧化葡萄糖制取葡萄糖酸,在工藝條件合適時,具有選擇性好、產品純度及收率高且無三廢排放等特點。葡萄糖屬于多羥基化合物,根據IR和NMR的測定結果,在水溶液中,葡萄糖存在著α—異構體、β—異構體及醛式(直鏈式)三種構體的平衡體系,其中β—異構體約占64%,α—異構體約占36%,醛式構體只有少量。葡萄糖的α—異構體和β—異構體都能被氧化劑所氧化,但被氧化的速度不同,β-異構體的氧化速度約為α-異構體的39倍。如果β-異構體被氧化, 溶液中葡萄糖的平衡體系被破壞, α-異構體向β-異構體轉化, 使得葡萄糖能較為完全地被氧化。氧化劑的選用**關重要,如果選用氧化能力太弱的氧化劑如游離碘等,勢必延長反應時間或氧化不完全,但若采用太強的氧化劑如高錳酸鉀、次氯酸鹽等,會造成伯醇和仲醇羥基被氧化,使單糖的碳—碳鏈斷裂,單糖降解。據理論分析和實驗探索,本實驗采用NaBr作為氧化劑。游離溴的氧化能力適中,它在水溶液中存在以下平衡Br
2+H
2O=HOBr+HBr 平衡常數為2.4×10
-8
在堿性條件下,溴是以次氯酸和次氯酸鹽形式存在,它們的氧化能力過強;在酸性溶液中,具有強氧化性OBr
-的濃度微小,溴主要以游離溴(Br
2)形式存在,游離溴是具有中等氧化能力的氧化劑,本實驗由于溶液中存在有糖酸,所有能保證氧化劑是以游離溴的形式來氧化葡萄糖。氧化的過程是shou先使β-D葡萄糖脫去兩個氫原子,生成D-葡萄糖酸1,5-內酯,經水解轉變成D-葡萄糖酸。β-異構體被氧化,引起α-異構體向β-異構體的轉化,使葡萄糖能較為完全地氧化成葡萄糖酸。游離溴能把葡萄糖氧化成葡萄糖酸后,本身被還原成溴離子,在電場的作用下,溴離子向陽極移動,失去電子成為Br
2重新氧化成葡萄糖,這使得NaBr能夠被重復使用。
電極反應:陽極:2Br
--2e→Br
2
陰極:2H
++2e→H
2↑
氧化還原反應:RCHO+Br
2+H
2O=ROOH+HBr
三、
實驗材料
1、
藥品:
|
藥品名稱 |
規格 |
|
備注 |
|
葡萄糖 |
AR |
G藥集團化學試劑有限公司 |
白色結晶粉末 |
|
溴化鈉 |
AR |
G藥集團化學試劑有限公司 |
白色結晶粉末 |
|
鄰苯二甲酸氫鈉 |
工作基準試劑 |
中G醫藥集團上海化學試劑公司 |
|
|
濃硫酸 |
分析純濃硫酸 |
|
|
|
NAOH |
AR |
|
白色均勻粒狀或片狀固體 |
|
乙醇 |
AR |
|
|
|
酚酞 |
指示劑 |
|
|
2、
儀器:
|
名稱 |
規格 |
數量 |
|
錐形瓶 |
250ml |
3 |
|
燒杯 |
500ml、250ml、150ml |
各1個 |
|
容量瓶 |
500ml(20℃) |
1 |
|
移液管 |
25ml、10ml、5ml |
各1支 |
|
稱量瓶 |
25×25 |
1 |
|
量筒 |
10ml、100ml |
各1個 |
|
酸、堿滴定管 |
|
各1支 |
|
球形冷凝管 |
|
1 |
|
四口燒瓶 |
|
1 |
#p#分頁標題#e#
2個石墨
電極、玻璃棒2支、洗耳球、橡膠管2根、膠頭滴管、藥匙、
W20113恒溫水浴鍋(上海申順生物科技有限公司)、 IKA RW20 Digital數顯型頂置式電動攪拌機、雙顯恒電位儀(
上海雷磁創益儀器儀表有限公司)、電子天平
四、
實驗內容
1、
溶液的配置
|
實驗步驟 |
實驗現象 |
|
酚酞的配置:取酚酞0.1g、乙醇(90%)100ml混合均勻后置于酚酞試劑瓶中 |
無色酚酞試劑 |
|
NaOH溶液的配置:取NaOH固體2g于燒杯中溶解后,用500ml容量瓶定容,保存在試劑瓶中 |
無色NaOH試劑 |
|
H2SO4溶液的配置:取9mol/L的H2SO4取2.8ml稀釋后,用500ml容量瓶定容,保存在試劑瓶 |
無色H2SO4溶液 |
2、
標定溶液
|
實驗步驟 |
實驗現象 |
實驗結果 |
|
NaOH溶液的標定:分別用錐形瓶取鄰苯二甲酸氫鉀0.4069g、0.3925g、 0.4052g加水溶解后加入2滴酚酞,用NaOH溶液滴定 |
鄰苯二甲酸氫鉀溶液由無色恰好變為紅色 |
C=0.1019955mol/L
|
|
H2SO4溶液的標定:分別取標定好的NaOH溶液10ml、 10ml、9.5ml加入2滴酚酞,用硫酸滴定 |
溶液由紅色恰好變為無色 |
C=0.0535476mol/L
|
3、
電解氧化葡萄糖生成葡萄糖酸
|
實驗步驟 |
實驗現象 |
① 稱取葡萄糖90.0g溶解后,用500ml容量瓶定容制成葡萄糖含量為18%的濃度;稱取NaBr 13.0 g,配成含NaBr2.6%的溶液
② 將500ml葡萄糖溶液加入反應瓶中,設置攪拌器400r/min,恒定流700mA,溫度55℃,設置完畢后,開啟工作鍵
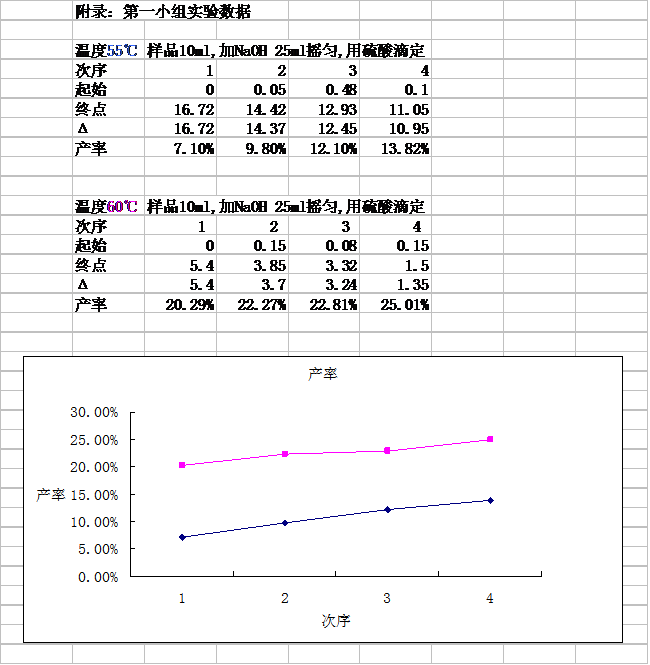
③ 3小時后,每隔1小時取反應液10ml,測糖酸的產率;空白對照組:NaOH25ml用硫酸滴定
分別于11:40、12:40、13:40 、14:40各取反應液10ml 于錐形瓶中,各加入NaOH25ml,搖勻,用硫酸滴定 |
8:40 開始
通電后有氣泡產生,溶液呈黃色
中間反應3小時
葡萄糖酸產率:
11:40 7.1%
12:40 9.8%
13:40 12.1%
14:40 13.82% |
4、
改變溫度
① 稱取葡萄糖90.0g,配成葡萄糖含量為18%的葡萄糖溶液500ml;稱取NaBr13.0g,配成含NaBr2.6%的溶液
② 溫度60℃,其它同前一次實驗
③ 同前一次實驗
分別于11:15、12:15 、13:15、 14:15各取反應液10ml 于錐形瓶中,各加入NaOH25ml,搖勻,用硫酸滴定 |
8:15開始
中間反應3小時
葡萄糖酸產率:
11:15 20.29%
12:15 22.27%
13:15 22.81%
14:15 25.01% |
五、
結果與討論
1、 經過分析實驗數據,得出實驗條件不變的條件下,葡萄糖酸的產率隨著反應時間的增加而增加,由于本次實驗的有限總反應時間為6h,所以不能判定在6h之后的反應中葡萄糖酸的產率是否會繼續隨著反應時間的延長而有所增加,但是我們猜想會有一個合理反應時間使葡萄糖酸的產率達到**大值。
2、 第二組反應溫度比**組高5度,但是產率卻大大高于**組,我們分析出現這種現象的原因可能是溫度升高在較短的反應時間內對反應速率影響較大。
3、 糖酸的產率計算式:=(V0-V2)×2C(H2SO4) ×196×0.001×100%/G , 式中:196 — 葡萄糖酸的分子量;G — 氧化前10ml樣品中葡萄糖的含量(g)。
因為葡萄糖酸的分子量196高于葡萄糖的分子量180,所以本計算式人為地放大了產率,若用摩爾產率會更精確。
4、 經過這次基礎化學實驗,我們從查閱文獻開始,到設計實驗方案,再到具體實驗操作,**后討論分析實驗結果,得到系統的實驗鍛煉,能力得到提升,也更加熟悉了解化學實驗,增加了對化學的興趣。#p#分頁標題#e#