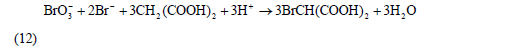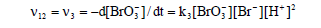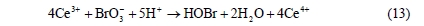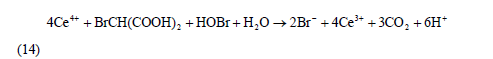摘要:本實驗對CH2(COOH)2-KBrO3化學振蕩體系進行研究,通過對實驗條件的控制和反應物質(zhì)的選取,探討化學振蕩反應的起振條件和機理,加深對振蕩反應的理解和對體系遠離平衡狀態(tài)下的復雜行為的認識。
關鍵詞:B-Z振蕩 起振條件 振蕩周期
Abstract:
In this study, B-Z chemical oscillating reaction Of CH2(COOH)2-KBrO3system was exploited to study the Chemical Oscillating Reaction. By controlling the experimental conditions and the selection of reaction materials, studying the mechanism of oscillating chemical reaction,to deepen the cognition of oscillating reactions and the understanding of the complex behavior of the system far from equilibrium state.
Keywords:
B-Z oscillating; Oscillation condition; Oscillation period;
前言
化學振蕩即化學反應系統(tǒng)中的某些物理量隨時間周期變化,是一個十分復雜的反應,包含了大量的化學反應物質(zhì),如反應物、生成物、中間體和催化劑,屬于非線性動力學范疇。B-Z化學振蕩是一類機理非常復雜的化學過程,F(xiàn)ield、Koros、Noyes三位科學家經(jīng)過四年的共同努力,于1972年提出**的FKN機理用來解釋B-Z振蕩反應的具體反應歷程,隨后又簡化出Oregonator模型。在1921年,Bray報道了在I2-HIO3作催化劑的條件下H2O2的催化分解在某些條件下呈現(xiàn)出明顯的振蕩現(xiàn)象,1958年,Belousov在硫酸介質(zhì)中以鈰離子作催化劑用溴酸鹽氧化檸檬酸出現(xiàn)振蕩反應,1964年,Zhabotinsky報道了其它體系中時空有序的振蕩現(xiàn)象。因而后人稱他們的研究為B-Z反應。目前在許多化學系統(tǒng)、生物化學系統(tǒng)中都發(fā)現(xiàn)了化學振蕩現(xiàn)象。這種現(xiàn)象引起了各學科工作者的濃厚興趣。
自20世紀50年代以來,化學振蕩在各個方面的應用日益廣泛。1995年,Perez-Bendito D及其合作者報道了利用被測物質(zhì)對化學振蕩體系的脈沖擾動進行分析測定,使化學振蕩現(xiàn)象步入了分析檢測實用階段。而后發(fā)展起來的電化學振蕩更廣泛地運用于理論研究和實踐,如仿生學、臨床醫(yī)學等。此外,在食品檢測與控制、環(huán)境保護等*域具有廣闊的應用前景。本實驗對CH2(COOH)2-KBrO3反應體系的化學振蕩進行研究,通過對實驗條的控制和反應物質(zhì)的選取,探討化學振蕩反應的機理,加深對振蕩反應的理解和對體系遠離平衡狀態(tài)下的復雜行為的認識。
實驗部分
儀器與試劑:
0.45M丙二酸,
0.20M溴酸鉀,
3M濃硫酸,4×10-3M硫酸鈰銨,
蒸餾水
乳酸(分析純),
丁二酸(分析純),
乙二酸(分析純),
檸檬酸(分析純),
碘化鉀(分析純),
硫酸錳(分析純),
硫酸鐵(分析純),
JB-1B型磁力攪拌器
上海雷磁新涇儀器有限公司;
N2000雙通道色譜工作站 浙江大學智能信息工程研究所;
HS-4精密恒溫浴槽 成都儀器廠
實驗步驟:
1. 不同反應物加入順序?qū)Ψ磻挠绊懀?br />
調(diào)節(jié)恒溫槽使溫度恒定在35°C,通恒溫水于玻璃恒溫夾套反應皿中,將丙二酸(10mL)、溴酸鉀(10mL)、濃硫酸(10mL)、蒸餾水(10mL)、硫酸鈰銨(10mL)中的三種物質(zhì)先移入,開動攪拌器,恒溫10分鐘。再將剩下的一種物質(zhì)迅速加入反應皿中,從剛加入一半**后一種試劑時開始采集數(shù)據(jù)。觀察是否產(chǎn)生振蕩,測出振蕩周期和誘導時間。
2. 溫度對振蕩反應的影響:
固定反應物加入順序和用量,改變體系的溫度(25°C,30°C,35°C,40°C,45°C),考察其對誘導時間和振蕩周期的影響。
3. 反應物濃度對振蕩反應的影響:
在40°C恒溫條件以及相同的加入順序下,分別改變丙二酸、溴酸鉀、濃硫酸、硫酸鈰銨的濃度(體積用量按7mL,10mL,13mL,16mL變化),考察誘導時間和振蕩周期的變化。
4. 反應機理的探討:
改變反應體系的反應物,催化劑,用其它試劑替代,觀察化學振蕩是否依然發(fā)生,周期如何,探討B(tài)Z振蕩反應的機理。用0.45M丁二酸、0.45M乙二酸、0.45M乳酸、0.45M蘋果酸、0.45M檸檬酸代替丙二酸,用0.20M碘酸鉀、溴酸鈉代替溴酸鉀,用硫酸錳、硫酸鐵溶液代替硫酸鈰銨,分別進行實驗,觀察是否發(fā)生振蕩。
注意事項:
1. 實驗對溴酸鉀純度的要求很高,因此一定要沖洗干凈;
2. 攪拌器磁子的位置、轉(zhuǎn)速、穩(wěn)定性要實時控制;
3. 在加入**后一項反應物時,注意加到一半時即開始計時;
4. 必須使
電極被溶液浸沒,過程中溶液不足要加蒸餾水保證溶液體積50mL;
5. 加入前三種溶液后,要恒溫7—10min,混合均勻;
6. 采集數(shù)據(jù),峰數(shù)不能太少要5個以上。
實驗結(jié)果與數(shù)據(jù)分析
實驗結(jié)果:
1.實驗順序:
(每次均加入10ml去離子水)
|
加入順序 |
一 |
二 |
三 |
四 |
|
1 |
溴酸鉀 |
溴酸鉀 |
硫酸 |
丙二酸 |
|
2 |
硫酸鈰銨 |
硫酸 |
丙二酸 |
硫酸鈰銨 |
|
3 |
硫酸 |
丙二酸 |
硫酸鈰銨 |
溴酸鉀 |
|
4 |
丙二酸 |
硫酸鈰銨 |
溴酸鉀 |
硫酸 |
|
誘導時間t/min |
3.634 |
3.607 |
3.770 |
2.630 |
|
振蕩周期T/min |
0.732 |
0.727 |
0.780 |
0.796 |
#p#分頁標題#e#
圖像如下:
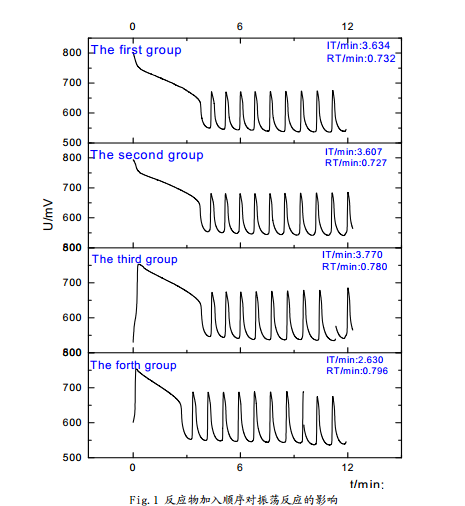
從圖中可以看出:在這四種情況下,體系均可以產(chǎn)生化學振蕩,但是誘導時間和振蕩周期略有差別。其中,第二組的體系振蕩周期**短,第四組的誘導周期**短。從理想的反應體系分析,振蕩的發(fā)生和振蕩周期應該與反應物質(zhì)的加入順序基本無關,因而基本相同,加入順序主要會影響到反應的誘導時間,但從實驗結(jié)果看,雖然四組反應振蕩周期和誘導時間基本一致,但是又略有差別,忽略反應偶然因素分析認為:
四組的細微差別可以佐證四組試劑在反應體系中地位的差別,結(jié)合CH2(COOH)2-KBrO3體系的振蕩反應的機理(此處僅分析FKN理論),不難解釋其原因:硫酸在體系中主要提供一個酸環(huán)境,在加入前反應體系的主要參與者均已完成加入和混合,丙二酸提供的部分氫離子可以使反應極為緩慢的略有進行,并且硫酸鈰銨溶液中本身含有酸成分,因此加入硫酸后所需誘導時間**短。硫酸鈰銨在體系中起到催化劑作用并作為化學振蕩中電子傳遞的媒介之一,因此**后加入時反應體系振蕩周期**短。
綜上,在以后的實驗中將采用第二組的加入順序進行研究,即溴酸鉀、硫酸、丙二酸、硫酸鈰銨。這是相對**佳的方式。
2.溫度對反應的影響:
|
|
35 |
40 |
45 |
50 |
55 |
|
誘導時間/min |
4.136 |
3.066 |
2.160 |
1.630 |
1.315 |
|
振蕩周期/min |
0.828 |
0.587 |
0.415 |
0.291 |
0.208 |
圖像如下:
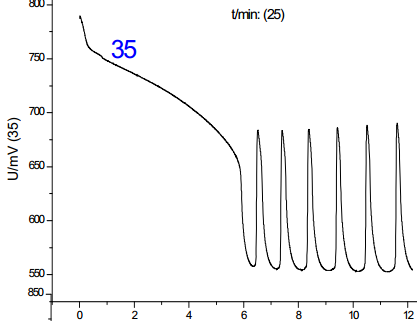
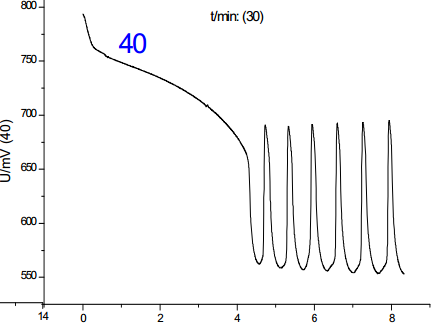
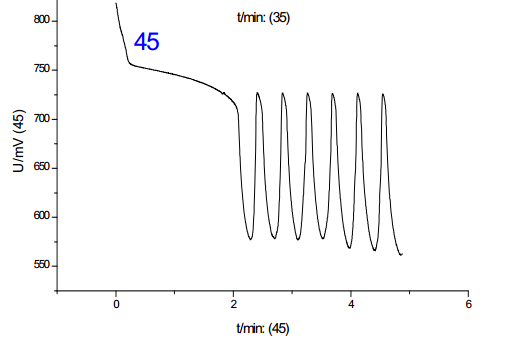
從諸圖中可以看出,溫度是影響振蕩的一大因素,并且影響是單向的:隨著溫度的上升,誘導時間和振蕩周期都減小;對比溫度對誘導時間和振蕩周期的影響,其影響程度基本一致,但考慮到其數(shù)值,溫度對誘導時間的影響更大。綜上,分析溫度對化學振蕩影響的機理,根據(jù)傳統(tǒng)物理化學理論(阿倫尼烏斯公式)可知,溫度的升高可以提高活性離子的比例,增加離子間有效碰撞幾率,從而加速反應進行,此外,由于該反應催化劑為離子溶液,該反應中溫度的上升有利于提高催化劑的活性,加快反應速度。但當溫度提高到50-60攝氏度時,震蕩周期到后來發(fā)生混亂,可見溫度只有在一定范圍內(nèi)提高才有利于反應的進行。**佳溫度約為45℃。
3.反應物濃度對反應的影響:
在45°C恒溫條件以及與以上相同的加入順序(蒸餾水、溴酸鉀、硫酸、丙二酸、硫酸鈰銨)下,分別改變丙二酸、溴酸鉀、硫酸鈰銨、硫酸的濃度(變化的體積用量按7mL,10mL,13mL,16mL變化,并相應的改變蒸餾水用量使反應體系總體積保持在50mL),考察誘導時間和振蕩周期的變化。
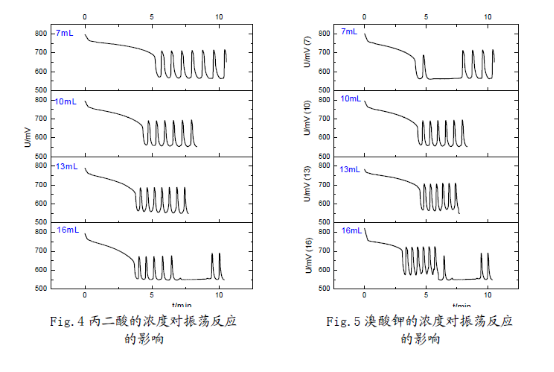
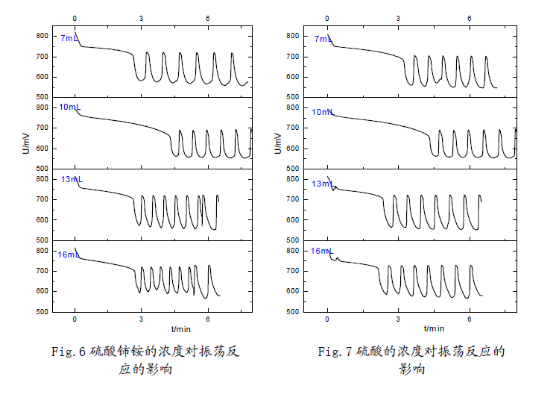
做出與誘導時間、振蕩周期與濃度相應的統(tǒng)計圖如下:
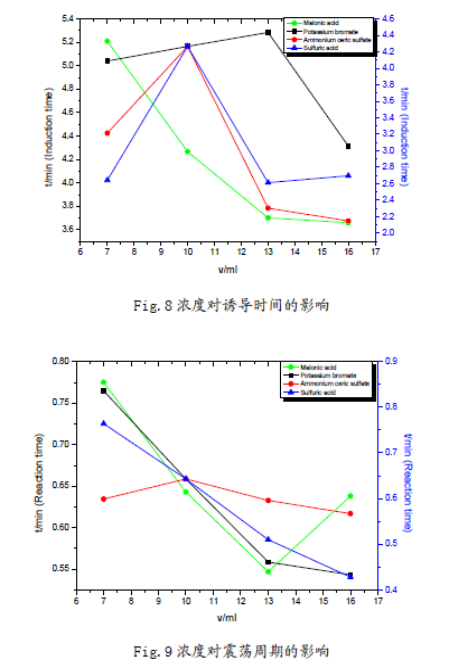
(1)在7mL—16mL范圍內(nèi),丙二酸、硫酸鈰銨濃度越高,化學振蕩的誘導時間越短;溴酸鉀濃度越大,化學振蕩的誘導時間先增后降;硫酸濃度增加,化學振蕩的誘導時間略有增加,但是變化幅度不大。因而可以認為,在適當濃度范圍內(nèi):丙二酸、硫酸鈰銨的濃度對誘導時
間有負影響;溴酸鉀的濃度對誘導時間有正影響,但是其存在一個**適濃度;硫酸的濃度對誘導時間影響不大。
(2) 溴酸鉀、硫酸濃度增大時,振蕩周期減小,近似線性關系;丙二酸濃度增大時,振蕩周期基本也呈線性下降趨勢,但是在16mL時振蕩周期突然升高;硫酸鈰銨對化學振蕩周期的影響較小,振蕩周期隨濃度增大先增后降,存在一個**適濃度。從硫酸鈰銨的異常性,結(jié)合機理中其作為催化劑,說明該催化劑對反應影響的多重性,可能與鈰離子催化反應中存在吸附極限有關。
(3) 觀察分析圖形可知:反應物的濃度不但影響了誘導時間和振蕩周期,同時還影響了振蕩的波形。濃度對振蕩體系的影響是比較顯著的;但濃度對振幅的影響卻不大,說明濃度對振蕩體系的各個參數(shù)的影響是有選擇性的。這也反映出化學振蕩體系本身的復雜性,及其極容易受反應環(huán)境的影響。
反應機理的探究:
改變反應體系的反應物、催化劑,用其它試劑替代,觀察化學振蕩是否依然發(fā)生、周期如何,探討B(tài)—Z振蕩反應的機理。#p#分頁標題#e#
用0.45M丁二酸、0.45M乙二酸、0.45M檸檬酸代替丙二酸,用0.20M碘酸鉀、溴酸鈉代替溴酸鉀,用硫酸錳、硫酸鐵溶液代替硫酸鈰銨,分別進行實驗,觀察是否發(fā)生振蕩
(1) 用0.45M丁二酸、0.45M乙二酸、0.45M檸檬酸代替丙二酸后,僅有蘋果酸、檸檬酸可以觀察到振蕩現(xiàn)象,乳酸沒有振蕩現(xiàn)象但是出現(xiàn)異常現(xiàn)象。
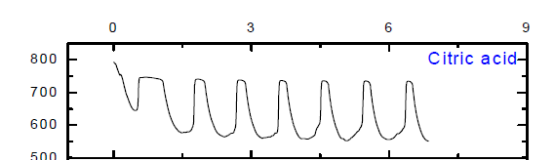
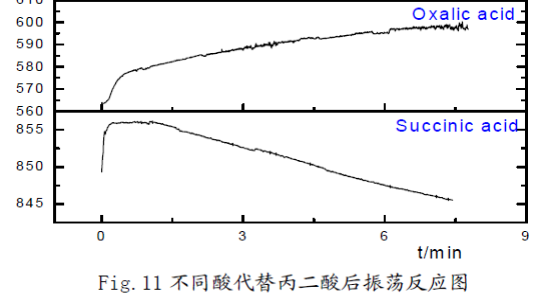
對比乙二酸與丙二酸:不可以看出僅有兩個羧基,無法發(fā)生振蕩反應,還必須有丙二酸中受羧基影響的活潑甲基; 對比丁二酸與丙二酸:丁二酸中有兩個羧基,并且有與羧基直接相連的活潑甲基,但是仍然無法發(fā)生振蕩反應,故丙二酸中活潑甲基同時受兩個羧基的影響就**關重要了;對比檸檬酸與丙二酸、丁二酸可知,當有機酸分子中活潑甲基同時受到兩個羧基,或者是一個羧基和一個羥基、或者是一個羧基和一個酮基的影響時,化學振蕩可能可以正常發(fā)生。由于實驗室沒有提供丁酮二酸,無法對其進行驗證實驗,但是查閱資料知,丁酮二酸代替丙二酸可以使化學振蕩正常.
結(jié)合CH2(COOH)2-KBrO3化學振蕩體系的FKN理論可知:丙二酸中活潑甲基可以被Br2取代,產(chǎn)生Br-。當Br-濃度達到一定值時,BrO3-又將其氧化生成Br2,由此形成Br-的振蕩。檸檬酸、蘋果酸和丙二酸在體系中作還原劑,將Ce4+還原成Ce3+。由于乳酸沒有活潑亞甲基,很難被Br2取代,因此無法產(chǎn)生Br-,觀察不到振蕩現(xiàn)象。
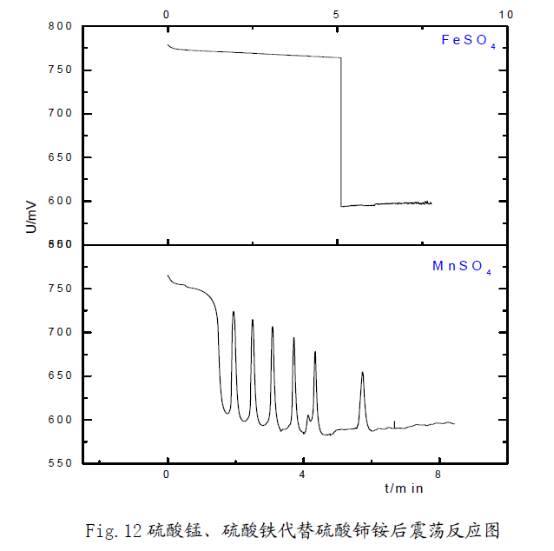
3) 用硫酸錳代替硫酸鈰銨后,可以看到振蕩現(xiàn)象,但是用硫酸鐵代替硫酸鈰銨,振蕩反應沒有發(fā)生,但是查閱資料知:Mn2+、Fe3+同樣具有催化作用。在振蕩體系中,錳元素存在Mn2+、Mn3+兩種形式,鐵元素以Fe2+、Fe3+的形式存在。

此時,濃度較大的Br2與丙二酸反應生成BrCH(COOH)2,即反應(8)。反應(8)與反應(11)構(gòu)成了Br-與Br2的循環(huán),其總體的宏觀效果(簡稱過程A)可表示為:
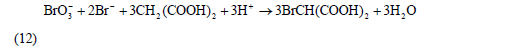
由于反應(3)是上述反應中**慢的一步,因此總反應(12)的速度由反應(3)決定,即
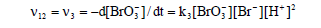
當Br-濃度較小時,占主導地位的反應為Ce3+被BrO3-氧化成Ce4+,即由反應(4)、(5)、(6)合成的第二個宏觀反應(簡稱過程B):
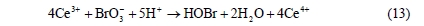
這一步總反應的反應速率由反應(5)決定。
Br-的再生可以由反應(1)、(9)、(10)合成第三個宏觀反應(簡稱過程C):
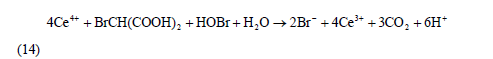
反應(12)、(13)、(14)組成了BZ振蕩體系的全過程,相互聯(lián)系、制約和切換。
在上述10個反應中,HBrO2具有自催化的特點,起著切換振蕩過程的開關作用。
該反應機理的核心是由HBrO2實現(xiàn)的自催化及其相應的正反饋機制。在反應體系中,主要存在著A、B兩種不同的總過程。在特定的時問或空間內(nèi),哪一種過程占優(yōu)勢取決于體系中溴離子的濃度。當溴離予濃度足夠大時,反應按A過程進行.隨著溴離子濃度的下降,反應從A過程切換到B過程,**后通過C過程使溴離子再生,因此,溴離子在振蕩反應中相當于一個選擇開關。金屬鈰離子在反應中起催化作用,催化B過程和C過程.隨著振蕩反應的進行,體系中的溴酸根離子逐漸減少,二氧化碳氣體逸出,體系的能量與物質(zhì)逐漸耗散,**終導致振蕩反應的結(jié)束。
化學振蕩條件的總結(jié)
(1)反應體系中應該有兩個穩(wěn)態(tài)存在,即具有雙穩(wěn)定性;
(2)反應歷程中應該包含自催化的步驟,該反應中HBrO2既是產(chǎn)物又是反應物;
(3)反應體系遠離平衡態(tài)。在封閉體系中反應會衰減,在敞開體系中可以長期持續(xù)振蕩;
(4)化學反應體系復雜,應該嚴格控制反應體系溫度、濃度、酸度、攪拌速度等。
振蕩波形異常的分析
(1)實驗過程中,磁力攪拌器中磁子的轉(zhuǎn)動并非時持續(xù)穩(wěn)定的,由于實驗室實驗設備的老化,實驗臺面的震動等因素,引起磁子不時上下跳動,旋轉(zhuǎn)不穩(wěn)定,對于化學振蕩反應的進行及實驗設備的測定帶來較大影響,使振蕩的波形出現(xiàn)小型的不穩(wěn)定峰,有時甚**會引起化學振蕩體系的崩潰,而使得振蕩中止;
(2)恒溫過程中,有微量試劑反應,帶來誤差;
(3)實驗室使用的試劑,尤其是溴酸鉀,不是現(xiàn)配現(xiàn)用,久置分解,對實驗帶來干擾;
(4)實驗過程中出現(xiàn)了幾次正常試劑與條件但是無法正常進行振蕩反應,**后正是是由于之前同學將試劑污染引起,同理由于試劑共用,也能由于其他同學的失誤將試劑污染,而帶來不可知影響;
(5)化學振蕩反應本身機理極為復雜,反應環(huán)境等帶來的細微誤差都極有可能使化學振蕩出現(xiàn)異常甚**是崩潰,故實驗中出現(xiàn)的較小的峰形異常,可以忽略;#p#分頁標題#e#
(6)由于不可知因素帶來的混沌效應等也會引起峰形異常
實驗改進建議
(1)更新實驗設備,做實驗過程中及時對磁子位置進行調(diào)節(jié);
(2)希望實驗室及時更新實驗試劑,尤其是溴酸鉀等溶液;
(3)實驗室應該提供更多試劑如丁酮二酸等
實驗結(jié)論
B-Z振蕩反應是一種典型的化學振蕩反應,其本質(zhì)就是在較強的酸環(huán)境中溴酸鹽氧化有機物,過渡金屬離子、金屬絡合物等作為催化劑,中間有自催化產(chǎn)物亞溴酸HBrO2的生成與消失。B-Z振蕩反應體系中的關鍵組分是催化劑和有機物,極電位在1.51~1.00V之間的金屬或金屬絡離子均可作為該體系的催化劑,還原劑的
電極電位應在1.0V以下。
B-Z振蕩反應是一個非常復雜的化學反應體系,溫度、濃度、酸度、攪拌速度等都可能影響振蕩反應的誘導時間、振蕩周期、振蕩壽命、振幅,乃**振蕩圖形。因此,在利用振蕩反應進行化學分析時應注意控制實驗條件。