摘 要:目的:研究綠色熒光蛋白(Greed Fluorescent Protein,GFP)基因的基因克隆及在大腸桿菌中的表達。方法:通過分別將DH-5α (pEGFP-N3)和DH-5α(pET-28a)提取質(zhì)粒、酶切并連接形成重組質(zhì)粒pET-28a-GFP,將重組質(zhì)粒導入E.coli DH-5α感受態(tài)細胞中進行轉(zhuǎn)化,通過限制性核酸內(nèi)切酶Not I與Bam H1和PCR對所建質(zhì)粒進行分析鑒定后, 通過轉(zhuǎn)化的方法把含綠色熒光蛋白(GFP)外源基因轉(zhuǎn)入大腸桿菌體BL-21內(nèi)進行表達,再用IPTG誘導GFP基因表達,可以看到顯現(xiàn)綠色,判斷GFP基因在大腸桿菌中成功表達。 結(jié)果:結(jié)果顯示構(gòu)建的重組質(zhì)粒pET-28a-GFP在E.coli中成功表達。
關(guān)鍵詞:綠色熒光蛋白;質(zhì)粒重組;原核表達;誘導表達
中圖分類號:Q53
Studies On Cloning and Expression of Green Fluorescent Protein gene
Abstract: Objective:Studies indicated that the cloning and expression of the GFP gene in the E.coli. Methods: Extract the plasmid of the DH-5α(pEGFP-N3) and DH-5α (pET-28a). Then cutting by enzyme and connecting the two plasmids to form pET-28a-GFP recombined plasmid. The recombinant plasmid confirmed by restriction enzyme and PCR transfected into E.coli DH-5α to ensure the expression of green fluorescent protein. Guiding the recombined plasmid, which contains exogenous genes of GFP into E.coli for expression, through transformative method. The expression of GFP gene can be induced by the IPTG and then we can see green. Results: The results suggest that pET-28a-GFP recombined plasmid has successfully expressed in E.coli.
Keywords: Ged Fluorescent Protein; Recombined Plasmid; Prokaryote Expression; Induced Expression
綠色熒光蛋白的基因克隆和表達的研究
引言
隨著分子生物學和基因工程技術(shù)的迅速發(fā)展和廣泛應用, 人們根據(jù)自己的意愿有目的、有計劃、有根據(jù)、有預見地將外源基因?qū)雱游锛毎麅?nèi), 使外源基因進行表達、闡明基因表達的調(diào)控機理或者通過與染色體基因組進行穩(wěn)定整合,將生物性狀傳遞給子代動物的研究方興未艾
[1]。
基因標記技術(shù)是近年來發(fā)展起來的分子生物學技術(shù)。熒光蛋白基因在標記基因方面由于具有獨特的優(yōu)點而引起了科學家的廣泛關(guān)注,現(xiàn)已被普遍應用到分子生物學研究的各個方面。熒光蛋白是海洋生物體內(nèi)的一類發(fā)光蛋白,分為綠色熒光蛋白、藍色熒光蛋白、黃色熒光蛋白和紅色熒光蛋白
[2]。
2008 年10 月8 日,瑞典**科學院把今年的諾貝爾化學獎授予綠色熒光蛋白的發(fā)現(xiàn)者和推廣者。他們分別為日本科學家下村修(Osamu Shimomura)、美G科學家馬丁·查爾菲(Martin Chalfie)和錢永健(Roger Tsien)
[3]。1962 年,下村修等分離純化了水母中發(fā)光蛋白水母素,并發(fā)現(xiàn)一種綠色的熒光蛋白。1974 年,他們分離得到了這個蛋白,當時稱綠色蛋白,以后稱綠色熒光蛋白(GFP)
[4] 。1994 年,查爾菲等**在大腸桿菌細胞中表達了能發(fā)射綠色熒光的GFP,開創(chuàng)了GFP 研究與應用之先河
[5]。
綠色熒光蛋白( green fluorescent p rotein, GFP)是238 個氨基酸組成的單體蛋白,其分子量為27 kDa。GFP 作為一種新的報告基因,與以往lacZ、CAT 等報告基因相比,有很多無可比擬的優(yōu)越性: GFP 不具有種屬依賴性,在多種原核和真核生物細胞中都表達;熒光強度高,穩(wěn)定性高;不需要反應底物與其他輔助因子,受藍光激發(fā)產(chǎn)生綠色熒光,尤其適用于體內(nèi)的即時檢測;另外GFP 分子量小,易于融合,適用于多種轉(zhuǎn)化方式,對受體無毒害,安全可靠;并且通過替換一些特殊氨基酸,可以使之產(chǎn)生不同顏色的光,從而適應不同的研究需要。正是由于GFP 檢測具有高靈敏度,操作簡單,無需使用同位素等優(yōu)點,近年來廣泛用于基因的表達與調(diào)控、蛋白質(zhì)的定位、轉(zhuǎn)移以及相互作用、信號傳遞、轉(zhuǎn)染與轉(zhuǎn)化,以及細胞的分離與純化等研究*域
[ 6~7] 。采用GFP 作為標記基因,可直接收集轉(zhuǎn)化細胞供實驗,縮短了篩選時間、減少對細胞活性的影響并可作為活體標記,為研究發(fā)育的基因調(diào)控和分子機制提供了一種簡潔有效的手段
[ 8、9 ] 。采用基因工程手段生產(chǎn)GFP 標記的方法,可建立一種簡便、快速的免疫診斷技術(shù)
[10] 。
質(zhì)粒轉(zhuǎn)化進入大腸桿菌(
Escherichia coli)感受態(tài)細胞是分子克隆的關(guān)鍵步驟
[11],是基因克隆以及DNA文庫構(gòu)建等研究中頻繁使用的一項重要的常規(guī)操作。一般實驗室沒有電穿孔技術(shù)所需要的特殊儀器,而利用氯化鈣法將質(zhì)粒重組入大腸桿菌細胞,操作方便、應用廣泛.目前, 感受態(tài)細胞的制備主要采用CaCl
2 法, 該方法操作簡單、容易掌握、重復性好、轉(zhuǎn)化率高, 可廣泛應用于一般的實驗室。其原理是Ca
2+ 破壞細胞膜上的脂質(zhì)陣列,并與膜上多聚羥基丁酸化合物、多聚無機磷酸形成復合物以利于外源DNA 的滲入
[12]#p#分頁標題#e#。
PCR 技術(shù)是Kary Mullis 在1985 年建立起來的在細胞體外合成DNA 的一種方法。依DNA 半保留復制原理,利用DNA聚合酶依賴于DNA 模板的特性,在附加的兩個引物與模板雜交之后,按堿基配對原則經(jīng)酶促反應合成DNA 片段,包括模板變性、引物退火及用DNA聚合酶延伸兩個引物之間DNA 的一定次數(shù)的重復循環(huán),使包括在兩個引物5'端限定的特異性片段形成指數(shù)式積累。整個過程操作簡單,可在短時間內(nèi)在小管中獲得大量的特意的DNA 拷貝,這一特點使PCR 技術(shù)很快被應用到了分子生物研究的廣大*域
[13]。
大腸桿菌是**個用于重組蛋白生產(chǎn)的宿主菌,它不僅具有遺傳背景清楚、培養(yǎng)操作簡單、轉(zhuǎn)化和轉(zhuǎn)導效率高、生長繁殖快、成本低廉、可以快速大規(guī)模地生產(chǎn)目的蛋白等優(yōu)點
[14]。而且其表達外源基因產(chǎn)物的水平遠高于其它基因表達系統(tǒng),表達的目的蛋白量甚**能超過細菌中蛋白量的30 %,因此大腸桿菌是目前應用**廣泛的蛋白質(zhì)表達系統(tǒng)
[15]。大腸桿菌表達系統(tǒng)是目前**常用的外源蛋白表達系統(tǒng),大腸桿菌由于遺傳背景清楚、易操作,以及有大量可供選擇的克隆或表達載體,使之成為人們克隆表達外源基因的主要菌株
[16]。
隨著人們對原核和真核生物基因調(diào)控的了解,通過綜合控制基因轉(zhuǎn)錄、翻譯、蛋白質(zhì)穩(wěn)定性及向胞外分泌等諸多方面的因素,構(gòu)建出了多種具有不同特點的表達載體和工程菌株,以滿足表達不同性質(zhì)、要求的目的基因的需要。在原核細胞中表達蛋白質(zhì)的載體常用啟動子有T7啟動子、Trp啟動子-色氨酸啟動子、Tac啟動子、T7噬菌體中基因10 的啟動子及Lac啟動子等。Lac啟動子受分解代謝系統(tǒng)活化蛋白和cAMP的正調(diào)控和阻遏物的負調(diào)控,當加入乳糖或某些類似物IPTG可與阻遏蛋白形成復合物,使阻遏蛋白構(gòu)型改變,阻遏蛋白不再能與操縱基因結(jié)合,從而使結(jié)構(gòu)基因表達。根據(jù)原核生物基因表達特點選著載體進行目的基因克隆,然后轉(zhuǎn)入相應的菌種中表達目的蛋白質(zhì)
[17]。
研究綠色熒光蛋白在大腸桿菌體內(nèi)的基因克隆和表達。通過質(zhì)粒重組形成所需要的重組質(zhì)粒pET-28a-GFP,將重組質(zhì)粒導入大腸桿菌體內(nèi),通過酶切、PCR及用IPTG誘導檢測是否在大腸桿菌體內(nèi)誘導表達成功。根據(jù)電泳結(jié)果及熒光現(xiàn)象得出結(jié)論,重組質(zhì)粒在大腸桿菌體內(nèi)成功誘導表達。
1 材料與方法
1.1 材料
1.1.1 實驗材料
克隆菌
E.coli DH-**、表達菌
BL-21為本實驗室收藏菌種,質(zhì)粒 pET-28a 和 pEGFP-N3,引物,限制性內(nèi)切酶 Bam H1、 Not Ⅰ購自大連寶生物工程有限公司。
1.1.2 儀器設(shè)備
SIM-f140 SANYO Ice Maker(made in Japan)
Eppendof離心機5430R(Made in Germany)
電泳儀 (DYY-12型,北京市六一儀器廠)
電子天平 (AB204-N 型,Mettler-Toleda Group)
臺式離心機 (TGL-16C型,上海安亭科學儀器廠)
控溫磁力攪拌器 (HJ-3型,江蘇金壇市金南儀器廠)
調(diào)溫電熱套 (KDM型,武漢精華科教儀器有限公司)
ph計(雷磁PHS-3C型,上海精密科學儀器有限公司)
冰箱 (BCD-208K/A NCJN型,青島海爾股份有限公司)
臺式冷凍恒溫振蕩器 (THZ-C-1型,太倉市實驗設(shè)備廠)
手提紫外燈(WD-9403E型,北京市豐臺區(qū)造甲街128號)
生物潔凈工作臺 (BCM-1000型,蘇州凈化設(shè)備有限公司)
電熱恒溫水溫箱(SHW 21-420型,湖北省黃石市恒豐醫(yī)療器械有限公司)
瓊脂糖凝膠電泳電泳裝置、凝膠成像分析系統(tǒng)、酒精燈、培養(yǎng)皿、
移液槍、槍頭 、接種環(huán) 、酒精棉球 、滅菌槍頭 、Parafilm膜、離心管
1.1.3 試劑及溶液
|
50×TAE電泳緩沖母液(50 mL) |
|
|
Tris-堿 |
12.1 g |
|
冰醋酸 |
2.85 mL |
|
0.5 mol/L EDTA (pH 8.0) |
5 ml |
|
6×DNA電泳緩沖液 |
|
|
溴酚藍 |
0.25 % |
|
蔗糖水溶液 |
40%(W/V) |
|
液體LB培養(yǎng)基(pH7.0) |
|
|
胰蛋白胨 |
10 g/L |
|
酵母提取物 |
5 g/L |
|
NaCl |
10 g/L |
|
NaOH(1 mol/L) |
1 mL/L |
分裝后于121 ℃ 高壓滅菌20 min。(LB固體培養(yǎng)基是在液體LB中加瓊脂粉**1 %);#p#分頁標題#e#
|
溶液Ⅰ 50 mL |
|
|
葡萄糖 |
50 mmol/L |
|
Tris-Cl (pH 8.0) |
25 mmol/L |
|
EDTA (pH 8.0) |
10 mmol/L |
121℃高壓滅菌 15 min后置于0~4℃貯存;
|
溶液Ⅱ 100 mL |
|
|
NaOH |
0.2 mol/L |
|
SDS |
1% (W/V) |
用時由母液2 mol/L NaOH、10%(W/V) SDS稀釋現(xiàn)配;
|
溶液Ⅲ 100 mL |
|
|
KOAc (5 mol/L) |
60 mL |
|
冰乙酸 |
11.5 mL |
|
H2O |
28.5 mL |
121 ℃高壓滅菌 15 min后置于0~4 ℃貯存;
氯仿;
瓊脂糖;
滅菌的去離子水;
10×酶切緩沖液;
TaqDNA聚合酶;
TaqDNA聚合酶緩沖液;
滅菌的0.1 mol/L CaCl
2
標準相對分子質(zhì)量的DNA;
溴乙錠(EB)儲存液 0.5 µg/mL;
LB/Kan(50 µg/mL)固體培養(yǎng)基;
IPTG配成濃度為400 mM水溶液,-20 ℃保存?zhèn)溆茫?br />
卡那霉素(Kan)配成濃度為100 ug/mL水溶液,-20 ℃保存?zhèn)溆茫?br />
70%乙醇:用新開裝的乙醇和滅菌無離子水配成,放在0~4 ℃;
無水乙醇(分析純,武漢市中天化工有限公司)放在0~4 ℃;
RNase 母液:將RNase 溶于10 mmol/L Tris·Cl(pH 7.5)、15 mmol/L NaCl 配成的試劑中,配成10 mg/mL的溶液,在100 ℃加熱15 min,使可能溶有的DNase失活,然后緩慢冷卻**室溫,分裝成小份保存于-20 ℃;
1.2 方法
1.2.1 重組質(zhì)粒的構(gòu)建
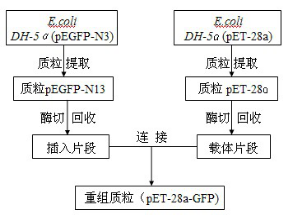
圖1重組質(zhì)粒pET-28a-GFP的構(gòu)建流程
Fig.1 The formed technological process of pET-28a-GFP recombined plasmid
1.2.2 DH-5α 和BL-21感受態(tài)細胞的制備
1) 將0~4 ℃保存的
DH-5α 和
BL-21菌種分別接種在LB液體培養(yǎng)基中37 ℃下250 r/min過夜培養(yǎng)16 h 。
2) 將分別接種過夜菌:LB按1:50的比例接種于2 mL的LB液體培養(yǎng)基中,37 ℃活化培養(yǎng)2~3 h**OD=0.3~0.5 。
3) 取1.5 mL菌液轉(zhuǎn)入EP管中,置于冰上10 min, 然后于4 ℃下5000 r/min離心5 min。棄上清液,沉淀加入0.1 mL預冷的0.1 mol/L CaCl
2緩和懸菌。冰上放置15-30 min后,4 ℃下5000 r/min離心10 min。
4) 棄上清液,沉淀用0.1 mL預冷的0.1 mol/L CaCl
2(含15%甘油)緩和懸菌,放在-20 ℃冰箱內(nèi)保存。
1.2.3 感受態(tài)細胞的轉(zhuǎn)化
1) 取制備好的感受態(tài)細胞100 μl,冰上解凍,均勻懸浮。
2) 加入2 μl酶連產(chǎn)物,輕輕混勻,冰上靜置10-30 min。
3) 42 ℃水浴中熱擊70 sec后,冰上放置2 min。
4) 加入200 μl LB液體培養(yǎng)基,37 ℃,50-100 rpm振蕩培養(yǎng)1 h。
5) 取200 μl懸浮細胞涂布在含合適抗生素的LB固體培養(yǎng)基上,用涂布器均勻涂布,平皿正放靜置1-2 h后,封口膜封好平皿, 37 ℃培養(yǎng)倒置12-16 h。
1.2.4 堿法提質(zhì)粒
1) 感受態(tài)細胞經(jīng)轉(zhuǎn)化培養(yǎng)后,平皿內(nèi)有但菌落長出。
2) 用滅菌吸頭挑取單菌落,浸沒于2 mL含有抗生素的LB液體培養(yǎng)基中,37 ℃, 180 r/min振蕩培養(yǎng)過夜。
3) 取1.5 ml 培養(yǎng)物倒入微量離心管中,用微量離心機于4 ℃、11000 r/min 離心1分鐘,吸棄上清。
4) 向離心管中加入150 ml用冰預冷的溶液Ⅰ,用微量移液器吹打重懸沉淀。
5) 加入200 ml新配制的溶液 Ⅱ,蓋緊管口,快速顛倒離心管5次,冰上放置5分鐘。
6) 加入150 ml用冰預冷的溶液 Ⅲ,輕輕混勻,冰上放置3~5分鐘。
7) 用微量離心機于4 ℃、11000 r/min離心5分鐘,吸取上清轉(zhuǎn)移到另一離心管。
8) 加等體積氯仿400 ml抽提,振蕩混勻,用微量離心機于4 ℃、11000 rpm離心2分鐘,將上清轉(zhuǎn)移到另一離心管中。
9) 吸取上清液300 ml,向上清中加入2倍體積的無水乙醇,混勻后,于室溫放置2分鐘;用微量離心機于4 ℃、11000 rpm離心5分鐘,棄上清。
10) 用70%乙醇洗滌2次,再次4 ℃、11000 rpm離心5分鐘,沉淀于空氣中干燥。向已干燥的離心管內(nèi)加20 ml超純水溶解質(zhì)粒DNA,加入2 ml 10 mg/ml RNA酶,37 ℃處理1小時后于-20 ℃貯存。#p#分頁標題#e#
1.2.5 酶切鑒定
1) 取提取的質(zhì)粒8 ml于另一微量離心管中,加入2 ml Bam H I和Not I的酶切混合液,輕彈管外混勻反應物。
2) 離心,使溶液聚集在管底部。
3) 37 ℃,酶切反應。
1.2.6 瓊脂糖凝膠電泳
1) 稱取0.8 g瓊脂糖,放入到錐形瓶中,加入100 mL 1×TAE緩沖液,置微波爐或水浴加熱**完全融化,冷卻**60 ℃左右。
2) 輕緩倒入封好兩端和加上梳子的電泳膠板中,靜置冷卻30分鐘以上。
3) 將膠板除去封膠帶,加電泳緩沖液**電泳槽中,加液量要使液面沒過膠面1-1.5毫米,輕輕拔除梳子。
4) 吸取10 ml的質(zhì)粒與2 ml的上樣液混勻,吸取混合液將加入加樣孔。
5) 接通電泳槽與電泳儀的電源,設(shè)置電泳數(shù)據(jù)U=100 V, I=30 mA。
6) 當溴酚藍染料移動到距凝膠前沿1-2 cm處,停止電泳。
7) 在凝膠成像分析系統(tǒng)中觀察結(jié)果。
1.2.7 PCR-聚合酶鏈式反應
1) 將PCR管放置在冰盒上,按如下表格加入PCR反應體系各成分
|
PCR反應體系 |
各成分的量 |
|
template |
0.1 ml |
|
P1(20 mM) |
0.2 ml |
|
P2(20 mM) |
0.2 ml |
|
dNTPs(10 mM) |
0.4 ml |
|
Taqs(5 U/ml) |
0.2 ml |
|
10×PCR buffer |
2 ml |
|
ddH2O |
16.9 ml |
|
Total |
20 ml |
2) 將PCR管放入PCR儀中,設(shè)定PCR儀的循環(huán)參數(shù)。預變性95 ℃ 3 min,變性95 ℃ 30 s,退火60-55 ℃ 30 s,延伸72 ℃ 1 min 10個循環(huán),每個循環(huán)降0.5 ℃。變性95 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 1 min 20個循環(huán),72 ℃延伸 2 min。
3) PCR擴增完畢后,取出PCP管放在冰盒上。
4) 取8 ml擴增后產(chǎn)物,進行瓊脂糖電泳檢測。
1.2.8 pET-28a-GFP重組質(zhì)粒轉(zhuǎn)化到表達菌BL-21
1) 取100 μl感受態(tài)
BL-21,冰上慢速解凍,均勻懸浮。加入2 μl經(jīng)過酶切鑒定成功提取重組質(zhì)粒pET-28a-GFP,輕輕混勻,冰上靜置10-30 min。
2) 42℃水浴熱激70 s,冰上放置2 min。
3) 加入200 μl 含抗生素的LB液體培養(yǎng)基,37 ℃,60 r/min震蕩培養(yǎng)30 min。四支EP管中加入0.5 μl 的100 mM的IPTG誘導,另外EP管中不加入IPTG誘導。
4) 吸取200 μl菌液涂布于含抗生素的LB平板上,用涂布器均勻涂布,平皿正放靜置1-2 h后,封口膜封好平皿, 37 ℃培養(yǎng)倒置12-16 h。
1.2.9 重組綠色熒光蛋白(GFP)的誘導表達
1) 取GFP重組菌接種于2 ml LB培養(yǎng)液(含Kana 100 mg/l)中,37 ℃ 150-220 r/min過夜培養(yǎng)。
2) 將20 μl菌液按1:50—100接種于2 ml LB培養(yǎng)液(含Kana 100 mg/l)中,37 ℃ 200r/min培養(yǎng)2h。
3) 按IPTG: LB培養(yǎng)基按1:1000加入2 μl的IPTG誘導表達,繼續(xù)培養(yǎng),對照組不加IPTG誘導。
4) 用紫外線照射菌體沉淀,保存照片。
2 結(jié)果與分析
2.1 提取質(zhì)粒




圖1 提取質(zhì)粒時加入各溶液的現(xiàn)象
A. 加入溶液1渾濁;B. 加入溶液2變澄清;C. 加入溶液3出現(xiàn)白色絮狀沉淀;D. 加入氯仿抽提溶液分層
2.2 重組質(zhì)粒構(gòu)建的鑒定
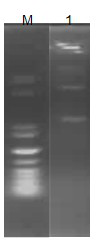
圖2 酶切重組質(zhì)粒pET-28a-GFP
Fig.2 indentification of pET-28a-GFP plasmid cleavage
Lane1:Marker protein;Lane 2:含目的基因的重組質(zhì)粒,得到有兩條帶,可知前面**條帶為GFP基因片段,第二條帶為質(zhì)粒載體,故成功構(gòu)建了重組質(zhì)粒pET-28a-GFP。
2.3 PCR檢測結(jié)果
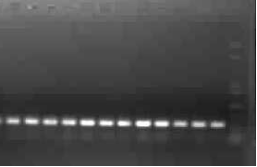
#p#分頁標題#e#
圖3 重組質(zhì)粒的PCR鑒定
Fig. 3 PCR indentification of pET-28a-GFP
PCR擴增后產(chǎn)物經(jīng)過電泳檢測,可以看到明顯的一條亮帶,其大小約為750 bp。可知eGFP基因成功連接到pET-28a載體。其前面不明顯的彌散的條帶為引物二聚體。
2.4 IPTG誘導表達

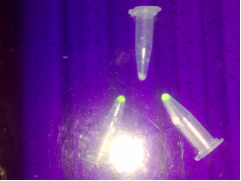
圖 4 日光燈和紫外燈下的表達結(jié)果
在日光燈和紫外光下,攜帶重組質(zhì)粒pET-28a-GFP的大腸桿菌
BL-21用IPTG誘導表達后呈現(xiàn)綠色,說明含外源基因GFP的質(zhì)粒在大腸桿菌
BL-21體內(nèi)成功表達;而沒有經(jīng)IPTG誘導的菌體則不發(fā)出綠色熒光。
3 討論
本實驗是一個綜合性實驗,與我們平時的實驗相比對我們的要求更多更嚴。它主要要求我們形成認真思考的習慣,自己查閱本實驗的相關(guān)文獻,分析本實驗的目的,通過本實驗要達到什么樣的結(jié)果,達到預計的結(jié)果需要通過怎樣的方案實現(xiàn),根據(jù)實驗需要和自己的相關(guān)了解自己設(shè)置適合的實驗方案,增強我們的思維能力和動手能力,同時也使我們的團隊合作精神得到了提高,并學會把我們所學的知識有機的結(jié)合到一起。跟我們平時的實驗相比較我們的實驗素養(yǎng)可以得到很大的提高,有利于我們今后的學習和研究。通過本次實驗我深刻的認識到了,在我們做研究的過程中一定要認真,每一步都不能出錯,否則將功虧一簣,從頭開始。
實驗中重組質(zhì)粒轉(zhuǎn)化進入
E.coli DH 5α中的轉(zhuǎn)化率很低,本組從
E.coli DH 5α中提取的質(zhì)粒共9管,酶切發(fā)現(xiàn)有重組質(zhì)粒存在的只有1管,轉(zhuǎn)化率不高。造成重組質(zhì)粒轉(zhuǎn)化率不高的原因可能有以下幾點:
(1)生長時期:實驗發(fā)現(xiàn)在對數(shù)中期的大腸桿菌易生感受態(tài),轉(zhuǎn)化時菌濃度應控制在不超過107個/ml。濃度過高或者過低都會影響轉(zhuǎn)化效率。
(2)CaCl
2法0 ℃放置時間的影響:細菌經(jīng)0 ℃ CaCl
2處理后轉(zhuǎn)化率隨時間的推移而增加,24 h達到**高,之后轉(zhuǎn)化率逐漸下降。
(3)化合物及無機離子的影響:在鈣離子的基礎(chǔ)上,聯(lián)合其他二價金屬離子或還原劑等物質(zhì)處理細菌,可使轉(zhuǎn)化率提高100-1000倍。
(4)質(zhì)粒大小、構(gòu)型的影響:用于轉(zhuǎn)化的質(zhì)粒DNA應主要是超螺旋態(tài)DNA。轉(zhuǎn)化效率與外源DNA的濃度在一定范圍內(nèi)成正比,但當加入外源DNA的量過多或體積過大時,轉(zhuǎn)化效率就會降低。1 ng超螺旋DNA即可使50 ul的感受態(tài)細胞達到飽和。一般情況下DNA溶液的體積不應超過感受態(tài)細胞體積的5%。
(5)防止雜菌和雜DNA的污染:整個操作過程均應在冰浴低溫和無菌條件下進行,所用器皿,如離心管、EP管等均應徹底洗凈,并經(jīng)高壓滅菌處理,所有的試劑都要滅菌,且注意防止被其他試劑、DNA酶或雜DNA所污染,否則均會影響轉(zhuǎn)化效率或雜 DNA的轉(zhuǎn)入,為以后的篩選、鑒定帶來不必要的麻煩。
(6)試劑的質(zhì)量:所用的試劑,如CaCl
2等均需是**高純度的,并用超純水配制,**好分裝保存于干燥的冷暗處。
(7)42 ℃熱處理時間很關(guān)鍵,轉(zhuǎn)移速度要快,且溫度要準確,同時注意熱處理過程中離心管不要搖動。
(8)菌液涂平皿操作時,應避免反復來回涂,因為感受態(tài)細胞的細胞壁有了變化,過多的機械擠壓涂布會使細胞破裂,影響轉(zhuǎn)化率。
在重組質(zhì)粒轉(zhuǎn)化
BL-21 細胞后,在平皿中用IPTG誘導長出菌苔,但未出現(xiàn)單菌落,可能的原因有:(1)菌液沒有涂開;(2)涂完后未先正放1h使菌液充分被LB吸收;(3)平皿上有水珠,未除去;(4)搖菌時間過長,菌過多。**后經(jīng)過IPTG誘導表達,本組中未有一管表達成功,僅有老師的兩管表達出綠色的熒光蛋白,表達量很低,可能的原因:(1)在轉(zhuǎn)化過程中,由于操作不當,使重組質(zhì)粒本身轉(zhuǎn)化進入
BL-21的量很少,故經(jīng)IPTG誘導表達量就很少。(2)pET-28a質(zhì)粒在菌體中的拷貝數(shù)本來就很低,和其他質(zhì)粒相比量會少一些,可以多搖一段時間,16-18h都可以,略微提高抗生素的濃度,有助于提高拷貝數(shù),加入IPTG后,有助于提高表達量。(3)由于表達菌株
BL-21沒有end-A突變,質(zhì)粒的完整性和保真性都不如
DH5α,因為裂解時會有大量多糖干擾,質(zhì)和量都不如
DH5α,pET質(zhì)粒拷貝數(shù)很低,故重組質(zhì)粒轉(zhuǎn)化
BL-21的效率相對較低;
DH5α是重組酶缺陷型,質(zhì)粒在細胞內(nèi)相對穩(wěn)定,而
BL-21為非重組酶缺陷型,轉(zhuǎn)化進入其中的重組質(zhì)粒不能穩(wěn)定存在,故GFP誘導表達量就相對較低。






 #p#分頁標題#e#
#p#分頁標題#e#
