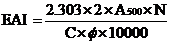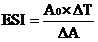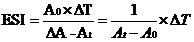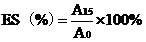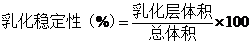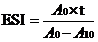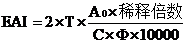摘要:乳化性質是蛋白質的一項重要功能性質,包括乳化活性和乳化穩定性。本文主要通過對蛋白乳化性質的介紹,綜述了其測定方法、不同的處理方式和不同的物化因素對乳化性的影響。
關鍵詞:蛋白質 乳化性 測定方法 影響因素
1 前言
乳化性質(Emulsibility)是蛋白質的一項重要的功能性質,是指油品和水形成乳狀液的能力,包括乳化活性(Emulsifying Properties)和乳化穩定性(Emulsifying stability)兩個方面。乳化活性是指蛋白質在促進油水混合時,單位質量的蛋白質(g)能夠穩定的油水界面的面積(m
2);乳化穩定性是指蛋白質維持油水混合不分離的乳化特性對外界條件的抗應變能力。
蛋白質乳化性是指蛋白質能使油與水形成穩定的乳化液而起乳化劑的作用
[1]。
2 乳化性質的測定方法
2.1 乳化活性的測定方法
2.1.1 分光光度法
阮詩豐
[2]等人采用722S型分光光度計對大豆分離蛋白乳化活性進行了測定。課題中具體的試驗方法如下:用微量取樣器取出底部的乳狀液50μL,用0.1%(W/V)SDS(十二烷基硫酸鈉)溶液稀釋到一定倍數后放入比色皿中,以相同的SDS溶液作參比液,立即測定其在500nm處的吸光度A。根據趙G華等
[3]的方法進行簡化,乳化活性EA用零時刻的吸光度來表征:
EA=A
0
或用乳化活性指數,即每克蛋白質的乳化面積來表示
[4]:
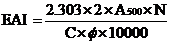
式中:C:溶液中樣品蛋白質濃度;Φ:油相體積分數;N:稀釋倍數
用分光光度計法測定多種大豆分離蛋白的乳化活性,每種測定均重復多次,計算結果的標準方差(SD:Standard deviation)和變異系數(CV:coefficient of variation)來反映此測定方法重復性。
鄧塔
[5]等人在研究大豆蛋白乳化性質的課題中,以脫脂大豆粉為實驗對象,取一定體積質量分數為2.0%的蛋白質溶液,加入同體積的大豆色拉油,以6400r/min的速度高速攪拌2min,之后在0min取樣100,以0.1%(w/v)SDS(十二烷基磺酸鈉,pH=7.0)稀釋50倍,以SDS溶液為空白,測定500nm處的吸光度值,以0min的吸光度值表示乳化性(EA)。
2.1.2 電導法
稱取一定量的大豆分離蛋白,溶解后使蛋白質溶液濃度在0.3 %~0.5%( w/v),10000 r/min 高速攪拌,同時用蠕動泵以4.0 mL/min的速度勻速向其中滴加大豆色拉油,用雷磁數據采集軟件采集電導值數據,當電導值發生突變時,停止加油,記錄耗油量 V
k。測定不同質量的蛋白質乳化油脂的量,通過多組數據進行回歸分析,計算出蛋白質的乳化能力 EC
[6]:
Y=aX+b
其中
Y:總耗油量Vk(mL)
X:蛋白質量M(g)
A:該種蛋白質的EC(mL/g)
2.2 乳化穩定性的測定方法
2.2.1 分光光度法
分光光度法測蛋白乳化穩定性的原理是乳化性越好,顆粒越小,吸光度越小;乳化穩定性越好,吸光度隨時間的變化越小,也即是粒徑變化不大。
高麗
[7]等人對大豆蛋白乳化穩定性進行了研究,課題中以優質大豆為研究對象,采用分光光度法測定的大豆蛋白的乳化穩定性。具體方法如下:將豆乳用蒸餾水稀釋28倍,用離心機以4000r/min離心5min,于785nm波長下測定離心前后的吸光度A。用下式計算豆奶的穩定性
R=A
2/A
1
式中,R為穩定性系數;A
2為離心后的吸光度;A
1為離心前的吸光度。R≤1,R值越大,說明豆乳的穩定性越好。
管軍軍
[8]等人采用分光光度法對大豆分離蛋白的乳化穩定性進行了測定,結果表明,用吸光值比K可較好地表示乳化穩定性。取9 mL0.1%(W/V)待測樣品蛋白液(樣品蛋白溶于0.2 mol/L、pH7.0磷酸緩沖液中),加入3 mL大豆色拉
油,在10 000 r/min,25℃下攪拌1 min,分別在攪拌后0 min、5 min取樣。以0.1%(W/V)SDS(pH7.0)稀釋50倍,測定在500 nm處的吸光值,以SDS溶液為空白,以0時刻的吸光值表示乳化性(EA)。乳化穩定性(ES)用乳化穩定指數(ESI)表示:
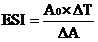
式中:A
0———0時刻的吸光值;
ΔT———時間差,min;
ΔA———ΔT內的吸光值差
上式可寫成:
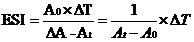
式中:At———t時刻的吸光值。
令K=A
t/A
0,則當ΔT一定時,K與ESI成正比關系。為了避免計算時出現ΔA為0及負值,我們引進吸光值比K來描述乳化穩定性,這里K=A
5/A
0(A
5為t=5 min時的吸光值)。
顧楠
[9]等人在研究不同處理方式對鷹嘴豆分離蛋白乳化性質的影響實驗課題中,采用分光光度法測定乳化穩定和乳化活性。具體方法如下:取一定量的鷹嘴豆分離蛋白溶于100mL的蒸餾水( 或一定離子強度的鹽溶液) 中,調節所需的pH,量取一定體積的大豆色拉油于蛋白溶液,以10000r/min的速度高速攪拌 2min,制成白色乳狀液。分別在0min和15min時取0.5ml乳狀液置于50mL的容量瓶中,加入0.1%(w/v)SDS(pH7.0)溶液定容并搖勻,以0.1%SDS溶液作空白,在500nm處測定其吸光度A,其中0min時吸光度A#p#分頁標題#e#
0表示為乳化活性EA,乳化穩定性用ES表示:
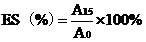
式中:A
0:乳化液在0min時的吸光值;;A
15:乳化液在靜置15min后的吸光值。
分光光度法測定蛋白質的EA(乳化活性)和ESI(乳化穩定性)時,要選擇合適的吸光度測定值范圍,一般應在0.200~0.800之間。
2.2.2 離心法
配制 1 %(w/v) 的蛋白質溶液,用 0.1 mol/L 的氫氧化鈉調** pH7.0,取一定體積的蛋白質溶液和同體積的大豆色拉油混合,以 10000 r/min 的速度高速攪拌1 min,所得乳狀液移3支10 mL 的離心管中,在70 ℃的水浴中恒溫25 min,用自來水冷卻**室溫,然后在2000 r/min的速度下離心10 min,根據乳化層體積計算乳化穩定性
[6]。
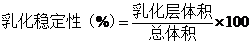
2.2.3 混濁度法
張根生
[10]等人在大豆分離蛋白乳化性的研究中采用混濁度法對蛋白乳化性進行測定。在0.2mol/L、pH7.0磷酸鈉緩沖液中配制 1%大豆分離蛋白溶液(W/V),加入大豆色拉油 0.025L/L,均質后形成均勻的乳化液。分別在0min 和10min 取1ml 新制備的乳化液,加99ml 蒸餾水稀釋100 倍,然后取1ml 被稀釋的乳化液加入到39ml的十二烷基磺酸鈉(SDS 1g/kg)稀釋40倍,**終稀釋度為4000倍。將**后溶液在500nm下測定吸光值(測定9次取平均值)。EAI和ESI采用如下公式進行計算:
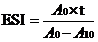
式中,ESI —乳化穩定性(min):
A
0—均質后迅速被稀釋的乳化液的吸光值;
A
10—乳化液在靜止10min 后的吸光值;
t—時間(本實驗是10min)
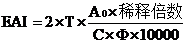
式中,EAI —乳化活性(ml/g);
T=2.303;
C—乳化液形成前蛋白質水溶液中蛋白濃度(g/ml);
Φ—乳化液中油的體積分數(本實驗是0.025);
稀釋倍數是 4000
3 不同物化因素對乳化性質的影響
3.1 pH值
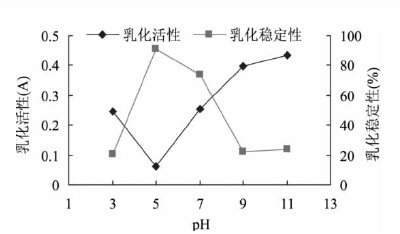
顧楠
[9]等人研究鷹嘴豆分離蛋白乳化性時,采用不同pH值梯度對其進行測定。pH值范圍選定為3、5、7、9、11,分別測量在不同pH處理過后的蛋白的乳化活性和乳化穩定性。結果如下:
圖1 pH對鷹嘴豆分離蛋白乳化活性及乳化穩定性的影響
在圖中很明顯的看出pH為5時,蛋白溶解度**小,即鷹嘴豆分離蛋白的等電點,此時蛋白溶解度**差,表面電荷為零,親水能力下降,吸附在油-水界面上的蛋白含量減少,故乳化活性降低;在靜置的過程中,由于不存在靜電排斥作用,蛋白質進一步在油-水界面重排乳化,同時在油-水界面堆積促進了高彈性膜的形成,阻止油滴聚集上浮從而提高了乳狀液的穩定性。pH從等電點向兩側變化,蛋白質的溶解度增大,蛋白質向油-水界面擴張能力增強,界面面積增大,乳化活力又開始增強,乳化穩定性又逐漸下降。
鄧塔
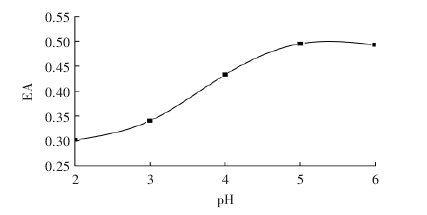
[5]等人在研究大豆乳化性質的課題中,采用不同梯度的pH值對大豆蛋白粉進行處理,加熱溫度為60℃下,采用1mol/L的鹽酸調節大豆蛋白溶液的pH,范圍為2.0-6.0,處理30min,測定其乳化性。結果如圖:
在此反應溫度下,隨著酸處理pH降低,大豆蛋白的溶解性降低,經酸處理時11S和7S發生變性,其中11S基本是全部變性,而7S是部分變性。變性蛋白在高溫下運動加劇而發生聚集,使蛋白質分子疏水性/親水性比值降低,減少油表面結合,影響蛋白質乳化性。同時蛋白質分子柔韌性降低,在界面不能迅速展開,影響大豆蛋白的乳化性。另一方面可能是在一定濃度下的大豆蛋白溶液隨pH升高,發生羧基去質子化,電荷排布改變,有利于乳化性的提高。
圖1 pH值對乳化性的影響
3.2 含油量
顧楠
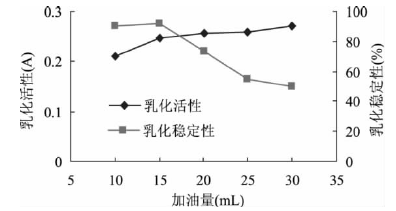
[9]等人在研究鷹嘴豆分離蛋白的乳化性時,設置不同梯度的含油量,分別為10、15、20、25、30mL,測定其乳化活性和乳化穩定性,結果如下:
圖2 加油量對鷹嘴豆分離蛋白乳化活性及乳化穩定性的影響
因為蛋白質是油和水的兩親物質,可自發地遷移**油-水界面,降低表面張力,形成穩定的乳狀液,隨著加油量的增加,所形成的界面面積增大,因而乳化活力增大;而且隨著加油量的增加,乳化穩定性呈現減小的趨勢,因為當油含量增高時,乳狀液油滴形成的保護膜較薄,導致蛋白質相互聚集下沉或油滴相互聚集上浮,從而使乳狀液失去穩定性,故乳狀液的穩定性隨油量的增加而降低。#p#分頁標題#e#
3.3 離子濃度
顧楠
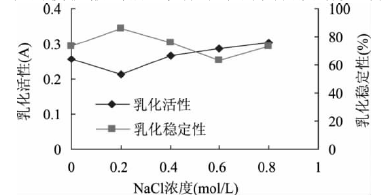
[9]等人在研究鷹嘴豆分離蛋白乳化性質時,選用不同梯度的離子濃度,分別為0.1、0.2、0.4、0.6、0.8mol/L的NaCl溶液,測定乳化活性和乳化穩定性。結果如下:
鹽濃度可以對蛋白表面疏水性和結構產生影響。在低鹽濃度時,溶液中的Na
+通過離子鍵吸附在蛋白質表面,中和蛋白質表面的負電荷,使蛋白質的親水性降低,疏水性增強,造成蛋白質構象發生變化,形成更加剛性的結構,使蛋白質的溶解性降低,從而使擴散到油-水體系中的蛋白質減少,界面面積減少,乳化活力下降。隨著NaCl濃度的升高,更多的Na
+吸附**蛋白質表面,使蛋白質的親水性增加,蛋白質分子溶劑化,使蛋白質的溶解性增大,從而使擴散到油-水體系中的蛋白質增多,界面面積增大,乳化活力上升。
圖3 NaCl濃度對鷹嘴豆分離蛋白乳化活性及乳化穩定性的影響
鄧塔
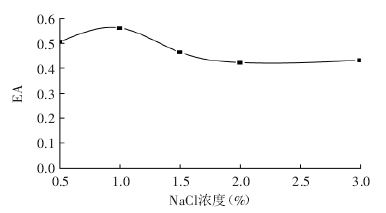
[5]等人采用不同濃度的NaCl處理改性后(加熱溫度為50℃、pH=6.0、加熱時間為60min)的大豆蛋白,分別向5份40mL2.0%的大豆蛋白溶液中添加不同劑量的NaCl,形成0.5%、1.0%、1.5%、2.0%、3.0%系列濃度。不同濃度的Na
+對改性大豆蛋白乳化性影響見圖4:
適當濃度的Na
+形成水合鹽與蛋白質分子上帶電基團微結合,提高了蛋白質結合水的能力,促進大豆蛋白溶解度增加和改善分子柔韌性,使其表面活性得到充分展示。
圖4 Na
+對改性蛋白乳化性的影響
4 不同的處理方式對蛋白乳化性質的影響
4.1 微波處理對蛋白質乳化性質的影響
顧楠
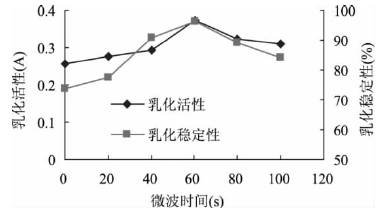
[9]等人對鷹嘴豆分離蛋白應用不同處理方式,并研究了這些處理方式對蛋白乳化性質的影響。課題中取100ml濃度為0.5%(w/v)的蛋白質溶液,用 0.5mol/L的NaOH調節pH為7.0,然后置于微波爐中處理,微波爐功率為800w,處理時間分別為0、20、40、6080、100s,處理完后加入20mL大豆色拉油,高速攪拌后根據2.2.1中所述方法測定EA和ES。
測定結果如下圖所示:
從圖中可以很明確的看出整體趨勢呈增加后減少,在微波處理時間為60s時,乳化活性和乳化穩定性都達到**大值。文中分析其原因是,蛋白分子在微波場的誘導下產生極化現象,使維持蛋白空間結構的非共價鍵(疏水相互作用、二硫鍵、靜電相互作用)被破壞,蛋白分子部分展開,分子的柔性提高,更多的蛋白分子結合到油-水界面,同時,蛋白分子內部的疏水殘基暴露在蛋白表面,蛋白表面的疏水性增強,故蛋白的乳化活性和乳化穩定性增強。但是,當微波處理的時間進一步延長時,蛋白分子進一步展開,極化的蛋白分子之間相互吸引,通過疏水相互作用、二硫鍵、靜電相互作用及氫鍵等重新形成分子聚集體,分子的柔性降低,表面疏水性減弱,蛋白表面積縮小,故乳化性及乳化穩定性呈下降趨勢。
圖1 微波處理對鷹嘴豆分離蛋白乳化活性和乳化穩定性的影響
4.2 超聲波處理對蛋白乳化性質的影響
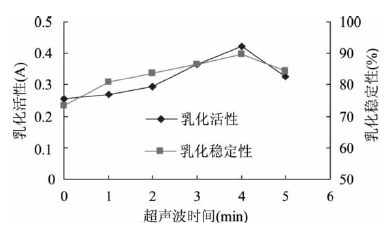
顧楠
[9]等人的研究中采用超聲波對鷹嘴豆分離蛋白進行處理,觀察超聲波不同的處理時間對其乳化活性及乳化穩定性質的影響。試驗方法類同微波處理,所選用的超聲波功率密度為0.3W/cm
2,處理時間分別為0、1、2、3、4、5min,結果如下:
從圖中明確看出,處理時間為4min時,乳化活性和乳化穩定性達到**大值。這是因為在超聲波作用下,蛋白質分子的結構變得疏松,使疏水性多肽部分展開朝向脂質,極性部分朝向水相,故乳化活力增加。但繼續延長超聲波處理時間,蛋白質變性程度增大,不溶性蛋白質含量增多,乳化活力及乳化穩定性隨之又降低。
圖2 超聲波處理對鷹嘴豆分離蛋白乳化活性和乳化穩定性的影響
4.3 超高壓處理對蛋白乳化性質的影響
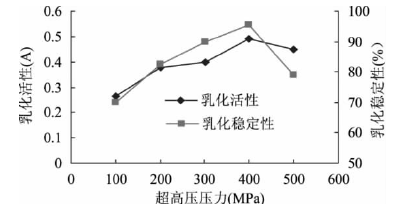
顧楠
[9]等人在研究鷹嘴豆分離蛋白的課題中,采用不同梯度的超高壓進行處理,壓力梯度為100、200、300、400、500MPa,處理時間均為15min。測定結果如下:
#p#分頁標題#e#
圖3 超高壓處理對鷹嘴豆分離蛋白乳化活性和乳化穩定性的影響
在壓力為400MPa時,其乳化活力和乳化穩定性達到**大值,這是由于超高壓使蛋白質結構發生了變化,蛋白質分子內部疏水相互作用逐漸受到破壞,更多的疏水性區域暴露,增加了蛋白的表面疏水性,疏水基團的暴露使蛋白質更易于吸附**油-水界面上并展開,從而提高了乳化性。隨著壓力的進一步增加,蛋白發生進一步聚集使得溶解性下降,導致吸附到油-水界面上的蛋白濃度下降,所以乳化性和乳化穩定性又出現下降。
4.4 加熱時間對蛋白乳化性質的影響
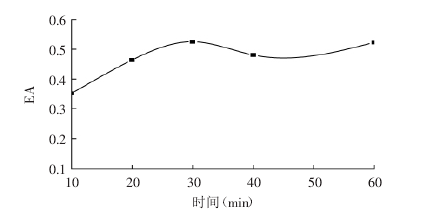
鄧塔
[5]等人采用不同梯度的加熱時間對大豆蛋白進行處理,在60℃,pH=5的條件下,處理10~60min大豆蛋白溶液,測定其乳化性。結果如圖:
圖2 加熱時間對乳化性的影響
適當熱處理初始階段蛋白質受熱而發生部分變性,多肽鏈展開增加了分子柔順性,有利于蛋白質分子在界面快速展開,乳化性得到顯著提高。隨時間的延長,變性的蛋白質減少,其乳化性增加變緩。